- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии
К большому сожалению, к Хавкину мы попали на консультацию поздно, уже после того, как мы испытали на себе все осложнения, которые вы можете прочитать в описаниях к гастро-протокольным препаратам, приняли на себя ребёнка — инвалида и потеряли илеоцекальный угол..
А. И. Хавкин - замечательный человек и хороший специалист.
Я делился научной информацией из всех источников, которые находил на просторах интернета, а некоторые мои публикации репостили на Facebook, в группе «Гастроэнтерология», которую вёл Анатолий Хавкин. Мы общались с ним некоторое время и в тот момент, когда мы остались на монотерапии Хумиры, мы встретились впервые не в виртуале, а в реале, на консультации. Он, в свою очередь, дал контакты другого гастроэнтеролога, Доктора наук, которая специализировалась на болезнях желудочно-кишечного тракта у детей, осложнённые герпес - вирусами:
Галина Васильевна Волынец — российский врач-гастроэнтеролог, ассистент кафедры гастроэнтерологии имени Пирогова. Она известна своей научной и клинической работой в области детской и взрослой гастроэнтерологии.
Биография
Точные даты рождения и другие личные данные Галины Васильевны Волынец в открытых источниках встречаются редко. Однако известно, что она работает в системе российского здравоохранения и связана с Национальным медицинским исследовательским центром (НМИЦ) или другим ведущим медицинским учреждением, где располагается кафедра гастроэнтерологии имени Пирогова.
Она специализируется на:
- Заболеваниях желудочно-кишечного тракта у детей и взрослых.
- Функциональных расстройствах пищеварения.
- Хронических воспалительных заболеваниях кишечника (ВЗК).
- Пищевой аллергии и непереносимости.
Научные публикации
Галина Васильевна активно участвует в исследованиях и публикует работы в российских и международных медицинских журналах.
Некоторые из ее публикаций:
1. "Особенности течения гастроэзофагеальной рефлюксной болезни у детей раннего возраста" (возможно, в соавторстве).
2. "Современные подходы к диагностике и лечению функциональных нарушений ЖКТ у детей".
3. "Роль микробиоты кишечника в развитии хронических заболеваний пищеварительной системы".
4. Участие в исследованиях по эффективности пробиотиков и диетотерапии при синдроме раздраженного кишечника.
Ее работы часто цитируются в российских медицинских кругах, особенно в контексте детской гастроэнтерологии.
Где работает?
Кафедра гастроэнтерологии имени Пирогова может быть связана с:
- РНИМУ им. Н. И. Пирогова (Москва).
- Национальным медицинским исследовательским центром детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (если речь о педиатрическом направлении).
Для точной информации о ее текущей деятельности лучше обратиться к:
- Базам научных публикаций (eLibrary, PubMed, CyberLeninka).
- Официальным сайтам медицинских вузов и НИИ.
Галина Васильевна Волынец — известный российский врач-гастроэнтеролог, доктор медицинских наук, специализирующаяся на воспалительных заболеваниях кишечника (ВЗК) у детей и их связи с герпесвирусными инфекциями. Ее научные работы и диссертационные исследования посвящены изучению влияния вирусов герпеса на течение ВЗК, иммунологическим аспектам патологии и разработке диагностических подходов.
Ключевые аспекты диссертационного исследования
1. Тема и направленность
- Исследование посвящено роли хронических активных герпесвирусных инфекций (ВПГ-1/2, ЦМВ, ВЭБ, ВГЧ-6) в exacerbation и тяжести течения ВЗК у детей .
- Анализировались лабораторные маркеры воспаления (СРБ, фибриноген, интерфероновый статус) и их корреляция с вирусной нагрузкой .
2. Основные выводы
- У 88.4% детей с ВЗК выявлены активные герпесвирусные инфекции, причем в 58.1% случаев — микст-инфекции (сочетанное поражение несколькими вирусами).
- Дисбаланс системы интерферонов: повышение сывороточного IFN при снижении индуцированного синтеза IFN-α и IFN-γ, что усугубляет воспаление .
- Лабораторные показатели активности ВЗК (например, уровень IgG, СРБ) были значимо выше у пациентов с герпесвирусными инфекциями .
3. Методология
- Включены 43 ребенка с ВЗК. Проводились:
- Серологические тесты (ИФА на антитела к HSV-1/2, EBV, CMV, VZV).
- ПЦР-диагностика ДНК вирусов в крови и биоптатах кишечника.
- Оценка интерферонового статуса .
4. Практическая значимость
- Работа обосновывает необходимость скрининга на герпесвирусы у детей с ВЗК для коррекции терапии (например, включения противовирусных препаратов) .
Научные публикации по теме
- «Воспалительные заболевания кишечника и хронические активные герпесвирусные инфекции у детей» (журнал *Детские инфекции*) — ключевая статья, где Волынец выступает соавтором. В ней детально разбирается связь ВЗК с дисфункцией иммунного ответа при герпесвирусной персистенции.
- «Заболевания верхних отделов ЖКТ у детей с хронической Эпштейна-Барр инфекцией» (*Российский педиатрический журнал*, 2004) — исследуются осложнения со стороны пищеварительной системы при EBV .
Место работы и должности
- Главный научный сотрудник гастроэнтерологического отделения НИКИ педиатрии им. Ю.Е. Вельтищева (РНИМУ им. Пирогова) .
- Ранее — сотрудник Научного центра здоровья детей (Москва) .
Дополнительные направления исследований
- Участие в разработке рекомендаций по диагностике ВЗК, включая дифференциацию с инфекционными поражениями ЖКТ .
- Лектор в Академии медицинского образования, где освещает современные подходы к лечению гастроэнтерологических патологий у детей .
Для более детального ознакомления с ее работами можно обратиться к базам eLibrary или CyberLeninka, где доступны полные тексты статей. Если вас интересует конкретная диссертация, уточните год защиты — в открытых источниках пока не найдено полного текста, но публикации отражают ее ключевые положения
Это были первые для меня гастроэнтерологи, которые были в теме иммунной недостаточности и вирусной нагрузки при хронических воспалительных процессах ЖКТ.
Однажды, меня даже пригласили Всероссийский съезд гастроэнтерологов в 2017 году, в качестве докладчика по последним научным достижениям, относительно болезни Крона. И вот тогда мне стало на самом деле страшно, так как я понял, что мало толковых специалистов в нашей стране по Внутренним Заболеваниям Кишечника. Слава Богу, на сцену вышел Алексей Головенко - популяризатор ликбеза по ВЗК среди врачей и пациентов.
Вот подробная информация об Алексее Олеговиче Головенко — враче-гастроэнтерологе, специалисте по воспалительным заболеваниям кишечника (ВЗК), медицинском переводчике и лекторе:
Биография
1. Образование
- Окончил факультет фундаментальной медицины МГУ им. М.В. Ломоносова в 2010 году .
- Прошёл ординатуру по гастроэнтерологии в Государственном научном центре колопроктологии им. А.Н. Рыжих .
- Кандидат медицинских наук (тема диссертации не указана в источниках) .
2. Профессиональный путь
- 2010–2017: Работал гастроэнтерологом в ГНЦ колопроктологии, где специализировался на ВЗК (болезнь Крона, язвенный колит) .
- 2017–2019: Гастроэнтеролог в GMS Clinic .
- С 2019 года — ведущий гастроэнтеролог клиники доказательной медицины «Рассвет» (Москва) .
- 2022–2024: После эмиграции в Германию (Фрайбург) продолжает консультировать пациентов онлайн, участвует в волонтёрских проектах как медицинский переводчик .
3. Специализация
- Воспалительные заболевания кишечника (30% практики — болезнь Крона, 20% — колит) .
- Функциональные расстройства ЖКТ (синдром раздражённого кишечника) .
- Автор и соавтор национальных клинических рекомендаций по лечению ВЗК и СРК .
Научная деятельность и публикации
1. Публикации
- Автор 20+ статей в рецензируемых журналах, включая исследования по диагностике и терапии ВЗК .
- Соавтор 3 учебных пособий для врачей .
- Участвовал в разработке рекомендаций по применению биологической терапии (инфликсимаб, адалимумаб) при болезни Крона .
2. Лекции и образовательные проекты
- Провёл более 50 семинаров для гастроэнтерологов, включая курсы по дифференциальной диагностике ВЗК .
- Лектор для общества пациентов с ВЗК — объясняет сложные темы доступным языком (например, видео «Как развиваются болезнь Крона и язвенный колит» на YouTube) .
- Участвовал в подкастах и интервью (например, «Сорок вопросов гастроэнтерологу» на «Серебряном Дожде») .
3. Ключевые темы исследований
- Связь психосоматики и функциональных расстройств ЖКТ .
- Оптимизация диагностики неэрозивной рефлюксной болезни .
Деятельность в Германии
- С 2022 года консультирует пациентов онлайн (включая россиян), помогает как переводчик в немецких больницах .
- Планирует сдать экзамены для работы гастроэнтерологом в Германии, но пока сохраняет практику в русскоязычном пространстве .
Отзывы пациентов
- Отмечают внимательность, отказ от ненужных анализов и акцент на доказательных методах лечения .
- Средний рейтинг: 4.9/5 (на основе отзывов на «ПроДокторов») .
Где найти его работы
- YouTube-канал с лекциями по ВЗК .
- Публикации в РИНЦ и международных журналах (уточнять по фамилии в научных базах).
Термин "заболевания ткани" в медицине не является строго определённым, но чаще всего под ним подразумевают патологии, связанные с поражением соединительной ткани или других типов тканей организма (мышечной, нервной, эпителиальной и т.д.). Вот основные группы таких заболеваний:
1. Системные заболевания соединительной ткани (СЗСТ)
Это аутоиммунные и воспалительные болезни, при которых иммунная система атакует компоненты соединительной ткани, присутствующей во многих органах.
Примеры:
- Системная красная волчанка (СКВ) — поражение кожи, суставов, почек, сердца.
- Ревматоидный артрит — хроническое воспаление суставов с вовлечением хрящевой и костной ткани.
- Системная склеродермия — фиброз кожи и внутренних органов.
- Дерматомиозит/полимиозит — воспаление мышц и кожи.
- Синдром Шегрена — поражение слюнных и слёзных желез.
2. Органоспецифические заболевания тканей
Патологии, затрагивающие определённый тип ткани в конкретном органе:
- Заболевания мышечной ткани:
- Миодистрофии (например, миодистрофия Дюшенна) — генетические нарушения, приводящие к разрушению мышц.
- Миастения гравис — аутоиммунная атака на нервно-мышечные синапсы.
- Заболевания костной ткани:
- Остеопороз — снижение плотности костей.
- Остеогенез несовершенный («болезнь хрустальных костей») — генетическое нарушение синтеза коллагена.
- Заболевания нервной ткани:
- Рассеянный склероз — аутоиммунное поражение миелиновых оболочек нервов.
- Нейродегенеративные болезни (болезнь Альцгеймера, Паркинсона) — разрушение нейронов.
- Заболевания эпителиальной ткани:
- Псориаз — аутоиммунное поражение кожи.
- Буллёзный эпидермолиз — генетическое нарушение структуры эпидермиса.
3. Генетические заболевания тканей
Связаны с мутациями генов, отвечающих за структуру и функцию тканей:
- Синдром Марфана — нарушение синтеза фибриллина (соединительная ткань).
- Эластическая псевдоксантома — поражение эластических волокон кожи, глаз, сосудов.
- Муковисцидоз — дисфункция эпителия дыхательных путей и ЖКТ.
4. Воспалительные заболевания тканей (неаутоиммунные)
- Фибромиалгия — хроническая боль в мышцах и соединительной ткани (точная причина неизвестна).
- Тендиниты, бурситы — воспаление сухожилий и суставных сумок.
5. Опухолевые заболевания тканей
- Саркомы — злокачественные опухоли соединительной ткани (костной, хрящевой, жировой).
- Карциномы — рак эпителиальных тканей (например, кожи, лёгких, кишечника).
Заключение
Группа "заболеваний ткани" условно объединяет патологии, связанные с нарушением структуры или функции соединительной, мышечной, нервной, эпителиальной и других тканей. Они могут быть:
- Аутоиммунными (ревматоидный артрит, СКВ),
- Генетическими (миодистрофии, синдром Марфана),
- Воспалительными (тендиниты),
- Дегенеративными (остеопороз),
- Опухолевыми (саркомы).
Для точной диагностики и лечения важно определить тип поражённой ткани и механизм заболевания.
При аутоиммунных заболеваниях иммунный ответ может быть направлен против разных типов антигенов, и в зависимости от этого выделяют несколько видов аутоиммунных реакций:
1. Тканеспецифический (органоспецифический) ответ
Иммунная система атакует антигены, характерные для конкретного органа или ткани.
Примеры:
- Тиреоидит Хашимото (антитела к тиреопероксидазе и тиреоглобулину)
- Болезнь Грейвса (антитела к рецептору ТТГ)
- Сахарный диабет 1 типа (аутоантитела к β-клеткам поджелудочной железы)
- Пернициозная анемия (аутоантитела к париетальным клеткам желудка и внутреннему фактору Касла)
2. Системный (неорганоспецифический) ответ
Иммунная система атакует широко распространённые антигены, присутствующие в разных тканях.
Примеры:
- Системная красная волчанка (СКВ) (антитела к ДНК, гистонам, нуклеопротеидам)
- Ревматоидный артрит (ревматоидный фактор, антитела к цитруллинированным белкам)
- Системная склеродермия (антитела к топоизомеразе I, центромерным белкам)
3. Смешанный (перекрывающийся) ответ
Некоторые заболевания сочетают признаки органоспецифического и системного аутоиммунитета.
Примеры:
- Аутоиммунный гепатит (антитела к гладкомышечным клеткам, ядерным антигенам)
- Первичный билиарный холангит (антитела к митохондриям)
4. Ответ против растворимых антигенов
В редких случаях аутоиммунные реакции направлены не против клеток или тканей, а против циркулирующих белков.
Пример:
- Аутоиммунная гемолитическая анемия (антитела к белкам эритроцитов)
- Идиопатическая тромбоцитопеническая пурпура (антитела к тромбоцитам)
Заключение
Аутоиммунные заболевания классифицируют по типу мишени:
- Органоспецифические (поражение одного органа)
- Системные (поражение многих тканей)
- Смешанные (промежуточные формы)
- Против растворимых антигенов (аутоантитела к белкам крови)
Эта классификация помогает в диагностике и подборе терапии.
Болезнь Крона можно рассматривать как заболевание ткани, несмотря на её иммуноопосредованный характер, из-за выраженного поражения структурных компонентов желудочно-кишечного тракта (ЖКТ) и системных проявлений. Вот ключевые причины:
1. Поражение всех слоёв кишечной стенки
При болезни Крона воспаление затрагивает все слои кишечной ткани (трансмуральное поражение):
- Слизистую оболочку (первичный очаг воспаления).
- Подслизистый слой (разрастание лимфоидных фолликулов).
- Мышечный слой (нарушение перистальтики).
- Серозную оболочку (риск перфорации и свищей).
Это приводит к структурным изменениям тканей:
- Фиброз (рубцевание стенки кишки).
- Стриктуры (сужение просвета кишечника).
- Свищи (патологические соединения между органами).
2. Системные проявления, связанные с тканями
Хроническое воспаление при болезни Крона не ограничивается ЖКТ. Оно может вызывать внекишечные поражения других тканей:
- Суставы: артрит (воспаление синовиальной ткани).
- Кожа: узловатая эритема, гангренозная пиодермия.
- Глаза: эписклерит, увеит (поражение сосудистой оболочки).
- Печень: первичный склерозирующий холангит (рубцевание желчных протоков).
Эти проявления напоминают системные заболевания соединительной ткани (например, ревматоидный артрит или СКВ).
3. Роль нарушения барьерной функции и тканевой регенерации
- Повреждение эпителиального барьера кишечника:
Дефекты в слизистом слое и клетках эпителия приводят к проникновению бактерий вглубь тканей, что запускает хроническое воспаление.
- Нарушение регенерации тканей:
Избыточное образование провоспалительных цитокинов (TNF-α, IL-6) подавляет восстановление слизистой оболочки, усугубляя фиброз и рубцевание.
4. Сходство с другими заболеваниями ткани
Болезнь Крона имеет черты, характерные для:
- Аутоиммунных заболеваний соединительной ткани (системное воспаление, фиброз).
- Органоспецифических патологий (локальное поражение ЖКТ).
- Фиброзирующих заболеваний (например, системной склеродермии).
Однако, в отличие от классических аутоиммунных болезней, при болезни Крона иммунный ответ направлен не на собственные ткани, а на микробиоту кишечника, что косвенно повреждает тканевые структуры.
5. Гистологические признаки тканевого повреждения
При биопсии выявляются:
- Гранулёмы (скопления иммунных клеток в подслизистом слое).
- Крипт-абсцессы (гнойное воспаление кишечных желёз).
- Лимфоцитарная инфильтрация (скопление Т-клеток и макрофагов в тканях).
Эти изменения подтверждают, что болезнь Крона — это хроническое воспалительное заболевание тканей ЖКТ.
Заключение
Болезнь Крона можно отнести к заболеваниям ткани, так как:
1. Она вызывает глубокое повреждение всех слоёв кишечной стенки.
2. Провоцирует системные поражения других тканей (суставы, кожа, глаза).
3. Сопровождается фиброзом и необратимыми структурными изменениями.
4. Имеет гистологические признаки хронического воспаления и нарушения регенерации.
Хотя её механизм отличается от классических аутоиммунных болезней (например, СКВ), тканевое повреждение остаётся центральным звеном патологии, что сближает её с другими заболеваниями соединительной и эпителиальной ткани.
На бумаге есть и подвижки. Не знаю, как это реализуется, конечно, но многие элементарные вещи, о которых мы говорили в 2017-м году, имеют результаты подтверждённые многочисленными исследованиями. Например:
Болезнь Крона у детей
Версия: Клинические протоколы МЗ РК - 2019 (Казахстан)
Показания для консультации специалистов [5,7,14]:
- консультация психотерапевта, психолога (невроз, планируемая операция с наличием стомы и т.п.);
- консультация эндокринолога (стероидный сахарный диабет, надпочечниковая недостаточность у больных на длительной гормональной терапии);
- консультация дерматолога (дифференциальный диагноз узловатой эритемы, пиодермии и т.п.);
- консультация ревматолога (при вовлеченности в аутоиммунный процесс суставов);
- консультация хирурга-колопроктолога – при подозрении на острую токсическую дилатацию толстой кишки, при отсутствии положительной динамики от консервативной терапии;
- консультация инфекциониста – в случае наличия оппортунистической инфекции, дифференциальная диагностика с инфекционными заболеваниями (диарейный синдром);
- консультация фтизиатра – исключение латентной инфекции перед индукцией α-ФНО терапии;
- консультация акушер гинеколога/гинеколога, с целью исключения ректовагинальных свищей;
- консультация окулиста, с целью исключения внекишечных проявлений, в виде признаков увеита или коньюктивита;
- консультация иммунолога, с целью исключения первичного иммунодефицита.
https:// diseases.medelement.com/disease/%D0%B1%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8C-%D0%BA%D1%80%D0%BE%D0%BD%D0%B0-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9-%D0%BA%D1%80-%D1%80%D0%BA-2019/17414
Или:
ECCO-2025: новые биомаркеры воспалительных заболеваний кишечника
В феврале в Берлине прошел конгресс Европейской организации по изучению болезни Крона и язвенного колита ECCO-2025. На нем представили новые исследования, посвященные раннему прогнозированию воспалительных заболеваний кишечника и их обострений и оценке ответа на лечение. Основной акцент сделан на метаболических маркерах и психосоциальных факторах риска.
БИОЛОГИЧЕСКИЕ СВОЙСТВА ЭНДОТОКСИНА КИШЕЧНОЙ МИКРОФЛОРЫ
Пензенский государственный университет
доктор биологических наук, профессор кафедры «Теоретические основы физического воспитания»
https:// web.snauka.ru/issues/2014/01/31034
Однако, не может быть одного протокола для всех пациентов ВЗК. Каждый ребёнок - это отдельный проект!
Болезнь Крона — хроническое воспалительное заболевание желудочно-кишечного тракта (ЖКТ) — относится к иммуноопосредованным заболеваниям с чертами аутоиммунного ответа, но её классификация не полностью соответствует традиционным категориям аутоиммунных реакций. Вот как это можно объяснить:
1. Особенности иммунного ответа при болезни Крона
- Не классический аутоиммунитет:
В отличие от типичных аутоиммунных заболеваний (например, ревматоидного артрита или СКВ), при болезни Крона иммунная система атакует не собственные ткани организма напрямую, а реагирует на микробиоту кишечника или компоненты пищи, что приводит к хроническому воспалению. Это связано с нарушением иммунной толерантности к комменсальным бактериям.
- Роль генетики: Мутации в генах, регулирующих иммунный ответ (например, *NOD2/CARD15*), повышают восприимчивость к дисрегуляции воспаления.
- Смешанные черты:
Болезнь Крона сочетает:
- Тканеспецифическое воспаление (поражает ЖКТ, чаще всего подвздошную кишку и толстую кишку).
- Системные проявления (возможны внекишечные симптомы: артрит, поражение кожи, глаз).
2. Почему её не относят к классическим аутоиммунным заболеваниям?
- Отсутствие четких аутоантител:
При болезни Крона не выявлены специфические аутоантитела, характерные для органоспецифических (например, антитела к β-клеткам при диабете 1 типа) или системных заболеваний (антинуклеарные антитела при СКВ).
- Дисрегуляция врожденного иммунитета:
В основе патологии лежит гиперактивация Th1- и Th17-лимфоцитов, макрофагов и провоспалительных цитокинов (TNF-α, IL-6, IL-23), что характерно для иммуноопосредованных, а не чисто аутоиммунных процессов.
3. Современная классификация
Болезнь Крона чаще рассматривают в рамках иммуноопосредованных воспалительных заболеваний (ИВЗ), где ключевую роль играют:
- Нарушение барьерной функции кишечника.
- Аномальный иммунный ответ на микробные антигены.
- Генетическая предрасположенность и факторы среды (диета, курение).
Если же пытаться вписать её в традиционную аутоиммунную классификацию, её можно отнести к смешанному типу из-за сочетания локального поражения ЖКТ и системных иммунных нарушений.
Примеры аналогичных заболеваний
- Язвенный колит (другое воспалительное заболевание кишечника) — схожие механизмы, но с поражением только толстой кишки.
- Псориаз — иммуноопосредованное заболевание с локальными (кожа) и системными проявлениями.
Заключение
Болезнь Крона не является классическим аутоиммунным заболеванием, но имеет черты органоспецифического воспаления (ЖКТ) и системной иммунной дисрегуляции. Её точный механизм остается предметом исследований, а терапия направлена на подавление гиперактивного иммунного ответа (анти-TNF-α препараты, иммуносупрессанты).
При аутоиммунных заболеваниях иммунный ответ может быть направлен против разных типов антигенов, и в зависимости от этого выделяют несколько видов аутоиммунных реакций:
1. Тканеспецифический (органоспецифический) ответ
Иммунная система атакует антигены, характерные для конкретного органа или ткани.
Примеры:
- Тиреоидит Хашимото (антитела к тиреопероксидазе и тиреоглобулину)
- Болезнь Грейвса (антитела к рецептору ТТГ)
- Сахарный диабет 1 типа (аутоантитела к β-клеткам поджелудочной железы)
- Пернициозная анемия (аутоантитела к париетальным клеткам желудка и внутреннему фактору Касла)
2. Системный (неорганоспецифический) ответ
Иммунная система атакует широко распространённые антигены, присутствующие в разных тканях.
Примеры:
- Системная красная волчанка (СКВ) (антитела к ДНК, гистонам, нуклеопротеидам)
- Ревматоидный артрит (ревматоидный фактор, антитела к цитруллинированным белкам)
- Системная склеродермия (антитела к топоизомеразе I, центромерным белкам)
3. Смешанный (перекрывающийся) ответ
Некоторые заболевания сочетают признаки органоспецифического и системного аутоиммунитета.
Примеры:
- Аутоиммунный гепатит (антитела к гладкомышечным клеткам, ядерным антигенам)
- Первичный билиарный холангит (антитела к митохондриям)
4. Ответ против растворимых антигенов
В редких случаях аутоиммунные реакции направлены не против клеток или тканей, а против циркулирующих белков.
Пример:
- Аутоиммунная гемолитическая анемия (антитела к белкам эритроцитов)
- Идиопатическая тромбоцитопеническая пурпура (антитела к тромбоцитам)
Заключение
Аутоиммунные заболевания классифицируют по типу мишени:
- Органоспецифические (поражение одного органа)
- Системные (поражение многих тканей)
- Смешанные (промежуточные формы)
- Против растворимых антигенов (аутоантитела к белкам крови)
Эта классификация помогает в диагностике и подборе терапии
Хронические инфекции, такие как туберкулёз кишечника, действительно вызывают разрушение тканей, и это сближает их с болезнью Крона. Однако ключевое отличие заключается в механизме повреждения и причине заболевания.
Почему болезнь Крона всё же относят к "заболеваниям ткани"?
Несмотря на сходство с инфекциями в плане разрушения тканей, болезнь Крона рассматривают в этом контексте из-за:
- Первичного нарушения тканевой структуры:
Воспаление при болезни Крона запускает не инфекция, а дисрегуляция иммунной системы, что приводит к аутоагрессии против собственных тканей (опосредованно, через реакцию на микробиоту).
- Необратимых изменений ткани:
Фиброз, стриктуры и свищи формируются из-за хронического воспаления, даже в отсутствие прямого патогена.
- Системного вовлечения тканей:
Поражение суставов, кожи, глаз напоминает классические системные заболевания соединительной ткани (например, СКВ).
3. Примеры других заболеваний с разрушением тканей
Для понимания разницы между механизмами:
- Аутоиммунное:
- *Ревматоидный артрит* — иммунная система атакует синовиальную оболочку суставов.
- *Рассеянный склероз* — разрушение миелиновых оболочек нервов.
- Инфекционное:
- *Остеомиелит* — разрушение костной ткани бактериями.
- *Сифилис* — гранулёмы и некроз в поздних стадиях.
- Дегенеративное:
- *Остеоартроз* — износ хрящевой ткани.
4. Важность классификации
Отнесение болезни Крона к иммуноопосредованным заболеваниям ткани (а не к инфекционным) важно для:
- Диагностики:
- При туберкулёзе выявляют микобактерии в биоптатах или ПЦР.
- При болезни Крона ищут неказеозные гранулёмы и исключают инфекции.
- Терапии:
- Лечение туберкулёза требует уничтожения бактерий.
- При болезни Крона подавляют гиперактивный иммунный ответ.
Заключение
Болезнь Крона и туберкулёз кишечника действительно схожи в плане разрушения тканей, но их принципиальные отличия — в причине (аутоагрессия vs инфекция) и механизме повреждения (хроническое воспаление vs прямое действие патогена). Болезнь Крона относят к заболеваниям ткани из-за доминирующей роли иммуноопосредованного воспаления, ведущего к структурным изменениям, что сближает её с аутоиммунными патологиями, а не с инфекциями.
- В случае вируса CoVID-19 иммунная система также реагирует на нового инфекционного зоонозного агента. В результате развивается цитокиновый шторм. Значит теоретически возможно, что болезнь Крона развивается из-за микроба, но в каждом случае, это может быть разный микроб. Поэтому начинается каскад нарушений, что приводит к аутоиммунному ответу. Не так ли?
- Вы поднимаете очень интересный и актуальный вопрос! Действительно, гипотеза о роли инфекционных агентов в развитии аутоиммунных заболеваний, включая болезнь Крона, активно изучается. Давайте разберёмся, насколько эта идея соответствует современным научным данным.
1. Сходство механизмов: инфекция → иммунный ответ → тканевое повреждение
Как при COVID-19, так и при болезни Крона ключевую роль играет гиперактивация иммунной системы, но есть принципиальные различия:
- COVID-19:
- Прямой триггер — вирус SARS-CoV-2.
- Цитокиновый шторм — чрезмерный выброс провоспалительных молекул (IL-6, TNF-α) в ответ на вирусную РНК.
- Острое повреждение тканей (лёгкие, эндотелий сосудов) из-за иммунной гиперреактивности.
- Болезнь Крона:
- Непрямой триггер — дисбиоз кишечника (нарушение баланса микробиоты), а не конкретный патоген.
- Хроническое воспаление — постоянная активация Th1/Th17-лимфоцитов и макрофагов.
- Аутоагрессия — иммунный ответ направлен не на собственные ткани, а на микробы, но при этом повреждаются клетки кишечника.
2. Может ли микроб быть триггером болезни Крона?
Идея о том, что разные микробы (бактерии, вирусы, грибы) могут запускать болезнь Крона у генетически предрасположенных людей, поддерживается исследованиями:
- Гипотеза молекулярной мимикрии:
Некоторые микробы имеют антигены, схожие с человеческими белками. Например, *Escherichia coli* и *Mycobacterium avium* изучаются как потенциальные триггеры перекрёстного иммунного ответа.
- Роль условно-патогенных бактерий:
При дисбиозе условные патогены (например, *Clostridium difficile*, *Fusobacterium*) могут:
- Повреждать эпителий кишечника.
- Активировать дендритные клетки и Т-лимфоциты через Toll-подобные рецепторы (TLR).
- Вирусы как кофакторы:
Некоторые вирусы (например, норовирусы, цитомегаловирус) могут нарушать иммунную толерантность к комменсальным бактериям.
3. Почему не у всех развивается аутоиммунный ответ?
Ключевой фактор — генетическая предрасположенность. Например:
- Мутации в гене *NOD2* (выявляются у 30–40% пациентов с болезнью Крона):
Нарушают распознавание бактериальных пептидогликанов и регуляцию воспаления.
- Другие гены: *ATG16L1*, *IL23R* — связаны с аутофагией и Th17-ответом.
Без "поломки" в генах даже агрессивные микробы, как правило, не запускают хроническое воспаление.
4. Примеры инфекций, связанных с аутоиммунными заболеваниями
- Ревматическая лихорадка → стрептококк группы А (молекулярная мимикрия с белками сердца).
- Болезнь Лайма → *Borrelia burgdorferi* (перекрёстный ответ на аксин).
- Целиакия → глиадин пшеницы (аутоиммунная реакция на тканевую трансглутаминазу).
Однако для болезни Крона конкретный инфекционный триггер не обнаружен??? — вероятно, это комбинация факторов.
5. Почему болезнь Крона — это не просто "инфекция"?
- Нет универсального патогена:
У пациентов выявляют разные комбинации микробов, а не одного возбудителя.
- Хроническое течение:
Воспаление сохраняется даже после устранения потенциального триггера.
- Эффект иммуносупрессии:
Лечение, подавляющее иммунитет (анти-TNF-α), не усугубляет болезнь (как при инфекциях), а улучшает состояние.
Заключение
Ваша гипотеза частично верна:
1. Микробы (особенно комменсальные бактерии) играют роль в развитии болезни Крона, нарушая иммунную толерантность.
2. Генетика создаёт "почву" для аномального ответа на микробиоту.
3. Аутоиммунный каскад запускается не прямым действием патогена, а дисрегуляцией иммунитета.
Однако болезнь Крона нельзя считать классическим инфекционным заболеванием. Это многофакторная патология, где микробы — лишь один из элементов сложного пазла, включающего генетику, эпителиальный барьер и иммунный ответ. Поиск конкретного "виновника" продолжается, но пока ключевой мишенью терапии остаётся контроль гиперактивного иммунитета.
- Но ведь если рассматривать хронические инфекционные заболевания, то они разрушают также разрушают ткани, например, туберкулёз кишечника
- Недостаточно T-reg а провоспалительная реакция обычная?
- Да, вы абсолютно правы: дисбаланс между регуляторными Т-клетками (T-reg) и провоспалительными реакциями играет ключевую роль в патогенезе болезни Крона и других аутоиммунных/иммуноопосредованных заболеваний. Разберём это подробнее.
1. Роль T-reg в норме
Регуляторные Т-клетки (T-reg) — это специализированные лимфоциты, которые:
- Подавляют избыточную активность эффекторных Т-клеток (Th1, Th17).
- Контролируют аутореактивные В-клетки и макрофаги.
- Поддерживают иммунную толерантность к собственным тканям и комменсальным микробам.
Их работа зависит от:
- Выработки противовоспалительных цитокинов (IL-10, TGF-β).
- Экспрессии транскрипционного фактора FoxP3.
- Взаимодействия с дендритными клетками через молекулы CTLA-4 и CD25.
2. Что происходит при болезни Крона?
Дефицит T-reg
- Снижение количества или функциональности T-reg:
У пациентов с болезнью Крона часто наблюдается уменьшение числа T-reg в слизистой оболочке кишечника и периферической крови.
- Причина: генетические дефекты (например, мутации в генах *IL-10*, *IL-10R*), дисбиоз микробиоты, нарушение микроокружения кишечника.
- Нарушение секреции IL-10:
IL-10 — ключевой цитокин, подавляющий воспаление. Его дефицит ведёт к неконтролируемой активации провоспалительных клеток.
Гиперактивация провоспалительных путей
- Th1/Th17-доминирование:
- Th1-лимфоциты выделяют IFN-γ, TNF-α, активируя макрофаги.
- Th17-клетки продуцируют IL-17, IL-22, усиливая воспаление и разрушение эпителия.
- Дисфункция макрофагов:
Макрофаги при болезни Крона вырабатывают избыток провоспалительных цитокинов (TNF-α, IL-6, IL-23) вместо подавления воспаления.
3. Почему провоспалительная реакция становится патологической?
В норме провоспалительные механизмы нужны для борьбы с инфекциями, но при болезни Крона:
1. Недостаток T-reg не сдерживает активацию Th1/Th17.
2. Генетические факторы (например, мутации в *NOD2*) нарушают распознавание бактерий, что ведёт к хронической стимуляции иммунитета.
3. Дисбиоз кишечника усиливает презентацию микробных антигенов, поддерживая воспаление.
Это создаёт порочный круг:
Дисбиоз → Активация врождённого иммунитета → Гибель эпителиальных клеток → Усиление проницаемости барьера → Новые микробные антигены → Хроническое воспаление.
4. Пример аналогии: цитокиновый шторм при COVID-19
Как и при COVID-19, где вирус вызывает гиперактивацию иммунитета, при болезни Крона:
- Провоспалительные реакции изначально "обычные", но из-за недостатка T-reg и генетических дефектов они выходят из-под контроля.
- Результат — хроническое повреждение тканей, а не кратковременная защита.
5. Терапевтические подходы, направленные на восстановление баланса
1. Стимуляция T-reg:
- Препараты низких доз IL-2 (для увеличения числа T-reg).
- Пробиотики (например, *Faecalibacterium prausnitzii*), повышающие выработку IL-10.
2. Подавление провоспалительных цитокинов:
- Анти-TNF-α терапия (инфликсимаб, адалимумаб???).
- Ингибиторы IL-12/IL-23 (устекинумаб).
3. Трансплантация фекальной микробиоты (ТФМ):
Восстановление здорового микробного сообщества может косвенно усилить функцию T-reg.
Заключение
Да, дефицит T-reg при болезни Крона действительно приводит к неконтролируемой провоспалительной реакции, даже если её механизмы изначально "обычные". Это сочетается с:
- Генетической предрасположенностью.
- Дисбиозом кишечника.
- Нарушением барьерной функции.
Восстановление баланса между регуляторными и провоспалительными клетками — ключевая цель современных методов лечения.
Продолжаем мыслить вслух...
- То есть если нет генетический поломки, значит это не болезнь Крона?
- Нет, отсутствие известных генетических мутаций не исключает диагноз "болезнь Крона". Это заболевание относится к многофакторным патологиям, где генетика — лишь один из элементов сложного взаимодействия. Вот как это работает:
1. Генетика — важный, но не обязательный фактор
- Гены повышают риск, но не гарантируют болезнь:
Мутации в генах (*NOD2/CARD15*, *IL23R*, *ATG16L1*) выявляются только у 30–40% пациентов с болезнью Крона. У остальных 60–70% явных генетических дефектов не обнаруживают.
- Пример: Мутация *NOD2* увеличивает риск в 2–4 раза, но у многих носителей этой мутации болезнь не развивается.
- Полигенный характер:
Риск зависит от комбинации множества генов с малым эффектом, а не одной "поломки". Даже при отсутствии известных мутаций другие генетические варианты могут влиять на восприимчивость.
2. Роль негенетических факторов
Даже при идеальной генетике болезнь Крона может развиться под действием:
а) Факторы окружающей среды
- Курение: Удваивает риск болезни Крона.
- Диета: Избыток рафинированных углеводов, недостаток клетчатки.
- Гигиеническая гипотеза: Слишком "стерильные" условия в детстве нарушают формирование иммунной толерантности к микробиоте.
б) Микробиота кишечника
- Дисбиоз: Нарушение баланса между "полезными" и патогенными бактериями (например, избыток *Escherichia coli*, снижение *Faecalibacterium prausnitzii*).
- Инфекции: Перенесённые кишечные инфекции (норовирус, сальмонеллёз) могут запустить хроническое воспаление у предрасположенных лиц.
в) Иммунная система
- Дисрегуляция Т-клеток: Преобладание провоспалительных Th1/Th17 над регуляторными T-reg.
- Дефекты аутофагии: Нарушение утилизации повреждённых клеток и бактерий (даже без мутаций в *ATG16L1*).
3. Примеры из практики
- Пациент А: Имеет мутацию в *NOD2*, но болезнь Крона не развивается благодаря здоровому образу жизни и сбалансированной микробиоте.
- Пациент Б: Нет известных генетических мутаций, но болезнь Крона диагностирована после длительного курения и эпизода тяжёлого дисбиоза.
4. Почему генетика не решает всё?
- Эпигенетика: Внешние факторы (диета, стресс, инфекции) могут включать/выключать гены, влияя на риск.
- Неизученные гены: Существуют ещё не открытые генетические варианты, связанные с болезнью Крона.
- Случайность: Иногда триггером становится непредсказуемое сочетание факторов.
5. Как ставят диагноз?
Диагноз не зависит от генетических тестов и основывается на:
1. Клинической картине: Хроническая диарея, боль в животе, потеря веса.
2. Эндоскопии: Характерные язвы, "булыжная" слизистая, трансмуральное воспаление.
3. Гистологии: Неказеозные гранулёмы, лимфоцитарная инфильтрация.
4. Исключении инфекций: Туберкулёз, паразиты, ВИЧ.
Заключение
Отсутствие выявленных генетических мутаций не исключает болезнь Крона. Это заболевание возникает при сочетании:
- Генетической предрасположенности (явной или скрытой),
- Дисбиоза микробиоты,
- Воздействия среды,
- Сбоев в работе иммунитета.
Генетика — важный "кусок пазла", но не весь пазл. Даже у людей без известных мутаций болезнь Крона может развиться под влиянием других триггеров.
- Какие ещё аутоиммунные заболевания известны с такими же мутациями в этих же генах, как и в случае с болезнью Крона?
- Аутоиммунные заболевания часто имеют общие генетические факторы риска, и некоторые гены, ассоциированные с болезнью Крона, также участвуют в патогенезе других аутоиммунных и воспалительных состояний. Вот ключевые гены и связанные с ними заболевания:
1. Ген *NOD2/CARD15*
Роль: Кодирует белок, участвующий в распознавании бактериальных пептидогликанов и регуляции врождённого иммунитета.
Мутации: Ассоциированы с болезнью Крона (особенно с поражением подвздошной кишки).
Другие заболевания:
- Саркоидоз — мутации *NOD2* повышают риск гранулематозного воспаления.
- Болезнь Бехчета — некоторые аллели *NOD2* связаны с ранним началом заболевания.
- Ревматоидный артрит — полиморфизмы *NOD2* могут влиять на тяжесть воспаления.
2. Ген *IL23R*
Роль: Кодирует рецептор интерлейкина-23, который активирует Th17-лимфоциты (ключевые игроки в аутоиммунном воспалении).
Мутации: Защитные варианты *IL23R* снижают риск болезни Крона и других Th17-опосредованных заболеваний.
Другие заболевания:
- Псориаз — полиморфизмы *IL23R* усиливают воспаление кожи.
- Анкилозирующий спондилит — связь с мутациями в *IL23R* подтверждена в крупных исследованиях.
- Псориатический артрит — общие генетические пути с болезнью Крона.
- Язвенный колит — часть пациентов имеют дефекты в *IL23R*.
3. Ген *ATG16L1*
Роль: Участвует в аутофагии — процессе утилизации внутриклеточных патогенов и повреждённых органелл.
Мутации: Ассоциированы с болезнью Крона (нарушение контроля за микробиотой).
Другие заболевания:
- Системная красная волчанка (СКВ) — дефекты аутофагии могут способствовать накоплению аутоантигенов.
- Целиакия — некоторые исследования указывают на связь *ATG16L1* с нарушением толерантности к глютену.
4. Ген *PTPN22*
Роль: Регулирует активацию Т- и В-лимфоцитов.
Мутации: Ассоциированы с множеством аутоиммунных заболеваний, включая болезнь Крона.
Другие заболевания:
- Ревматоидный артрит
- Системная красная волчанка
- Аутоиммунный тиреоидит
- Диабет 1 типа
5. Ген *TNF-α*
Роль: Кодирует фактор некроза опухоли альфа — ключевой провоспалительный цитокин.
Мутации: Полиморфизмы в промоторной области *TNF-α* связаны с болезнью Крона.
Другие заболевания:
- Ревматоидный артрит
- Псориаз
- Анкилозирующий спондилит
6. Ген *HLA* - у нас было отрицательно!
Роль: Гены главного комплекса гистосовместимости (MHC) регулируют презентацию антигенов.
Мутации: Аллели *HLA-DRB1* и *HLA-DQ2/DQ8* ассоциированы с болезнью Крона.
Другие заболевания:
- Целиакия (*HLA-DQ2/DQ8*)
- Рассеянный склероз (*HLA-DRB1*15:01)
- Диабет 1 типа (*HLA-DR3/DR4*)
Заключение
Гены, связанные с болезнью Крона, часто участвуют в патогенезе других аутоиммунных заболеваний из-за общих иммунных механизмов:
- Дисрегуляция Th1/Th17-ответа (*IL23R*, *TNF-α*).
- Нарушение врождённого иммунитета (*NOD2*).
- Дефекты аутофагии (*ATG16L1*).
Однако конкретные проявления зависят от:
- Тканевой специфичности воспаления.
- Влияния среды (диета, инфекции).
- Дополнительных генетических и эпигенетических факторов.
Например, мутация в *IL23R* может привести к псориазу у одного человека и болезни Крона у другого, что подчеркивает сложность взаимодействия генов и внешних триггеров.
- Все умершие ели огурцы. Но это не означает, что они все умерли из-за этого факта. Так ли это?
- Вы совершенно правы. Ваш пример прекрасно иллюстрирует ключевой принцип логики и научного мышления: корреляция (совпадение) не означает причинно-следственной связи. Давайте разберём это подробнее.
1. Почему это утверждение верно?
Если все умершие ели огурцы, это лишь показывает статистическую связь (корреляцию), но не доказывает, что огурцы стали причиной смерти. Возможны другие объяснения:
- Совпадение: Огурцы — популярный продукт, и их едят многие люди.
- Скрытый фактор: Умершие могли иметь общие черты, не связанные с огурцами (например, возраст, хронические болезни, образ жизни).
- Обратная причинность: Люди ели огурцы *потому что* были больны (например, из-за диеты).
2. Примеры корреляции без причинности
- «Чем больше мороженого едят, тем чаще тонут»
Корреляция есть, но причина — летняя жара (люди чаще купаются и едят мороженое).
- «Высокий уровень образования связан с долголетием»
Причина не в образовании, а в доступе к качественной медицине, здоровому образу жизни и финансовой стабильности.
- «Кофеин связан с тревожностью»
Тревожные люди чаще пьют кофе, чтобы взбодриться — это обратная причинность.
3. Как в науке отличают корреляцию от причинности?
Чтобы доказать, что А вызывает Б, нужно:
1. Исключить случайность: Повторить наблюдение в разных популяциях.
2. Учесть смешанные факторы (confounders):
- Например, связь «курение → рак лёгких» подтверждается только после учёта возраста, профессии, места жительства.
3. Провести эксперимент:
- Рандомизированные контролируемые исследования (РКИ) — золотой стандарт.
- Пример: Чтобы доказать, что огурцы убивают, нужно разделить людей на две группы: одна ест огурцы, другая — нет, и сравнить смертность.
4. Медицинский контекст (связь с предыдущими темами)
В обсуждении болезни Крона мы говорили о генетических мутациях (например, *NOD2*). Их наличие коррелирует с болезнью, но:
- Не у всех носителей мутации развивается заболевание.
- Болезнь может возникнуть и без этих мутаций.
Это означает, что генетика — лишь фактор риска, а не абсолютная причина. Как и с огурцами, нужны дополнительные триггеры: дисбиоз, экология, иммунные сбои.
5. Почему люди часто путают корреляцию и причинность?
- Когнитивные искажения:
- *Post hoc ergo propter hoc* («после — значит вследствие»): если Б случилось после А, кажется, что А вызвало Б.
- *Выборочное внимание*: мы замечаем совпадения, подтверждающие наши гипотезы, и игнорируем противоречащие.
- Упрощение сложных систем:
Причины болезней, климата, экономики редко сводятся к одному фактору.
Заключение
Да, ваше утверждение верно: совпадение событий (корреляция) не доказывает причинно-следственной связи. Это важно в медицине, науке и повседневной жизни. Например:
- Если пациенты с болезнью Крона едят огурцы — это не значит, что огурцы её вызвали.
- Если ген *X* встречается у людей с аутоиммунными болезнями — это не всегда делает его «виновником».
Чтобы делать выводы, нужно искать механизмы, экспериментальные доказательства и учитывать контекст.
ЯЖНЕВРАЧ 
Циркулирующие иммунные комплексы (ЦИК) и их роль в развитии хронических воспалительных состояний
1. Определение и образование ЦИК
ЦИК — это комплексы антигенов (чужеродные или собственные молекулы), связанных с антителами (IgG, IgM). В норме они образуются при иммунном ответе для нейтрализации патогенов и удаляются фагоцитами (макрофагами) или системой комплемента.
2. Патогенез хронического воспаления
При нарушении баланса между образованием и клиренсом ЦИК возникают патологические процессы:
- Избыточное образование:
- Хронические инфекции (гепатит B/C, ВИЧ).
- Аутоиммунные заболевания (системная красная волчанка — СКВ, ревматоидный артрит).
- Нарушение клиренса:
- Дефекты системы комплемента (C1q, C3).
- Снижение функции фагоцитов или ретикулоэндотелиальной системы.
3. Механизмы повреждения тканей
ЦИК откладываются в тканях, вызывая воспаление через:
- Активацию комплемента:
- Генерация анафилотоксинов (C3a, C5a), привлекающих нейтрофилы и макрофаги.
- Формирование мембраноатакующего комплекса (C5b-9), повреждающего клетки.
- Воспалительный ответ:
- Нейтрофилы высвобождают протеазы и активные формы кислорода.
- Активация Fc-γ рецепторов на иммунных клетках → выброс провоспалительных цитокинов (IL-1, TNF-α, IFN-γ).
- Отложение в тканях:
- Сосуды: васкулиты (например, при узелковом полиартериите).
- Почки: гломерулонефрит (СКВ, постстрептококковый).
- Суставы: синовит (ревматоидный артрит).
4. Примеры заболеваний
- Системная красная волчанка (СКВ): ЦИК с ДНК и антинуклеарными антителами откладываются в почках (люпус-нефрит), коже, суставах.
- Ревматоидный артрит: ЦИК (с ревматоидным фактором) в синовиальной оболочке → хроническое воспаление.
- Криоглобулинемия: ЦИК (криоглобулины) вызывают васкулиты и поражение почек.
5. Диагностика
- Определение уровня ЦИК в сыворотке крови (неспецифический маркер).
- Биопсия тканей (выявление отложений иммунных комплексов методом иммунофлуоресценции).
- Оценка активности комплемента (снижение C3, C4 при СКВ).
6. Лечение
- Подавление образования ЦИК:
- Иммуносупрессанты (глюкокортикоиды, циклофосфамид).
- Биологические терапии (ритуксимаб — анти-CD20).
- Удаление ЦИК:
- Плазмаферез.
- Блокада провоспалительных медиаторов:
- Ингибиторы TNF-α, IL-6.
7. Значение в хронизации воспаления
Постоянное образование ЦИК поддерживает порочный круг: повреждение тканей → высвобождение новых аутоантигенов → формирование новых ЦИК. Это приводит к фиброзу и необратимому повреждению органов.
Заключение
ЦИК играют ключевую роль в патогенезе хронических воспалительных и аутоиммунных заболеваний, выступая связующим звеном между иммунным ответом и повреждением тканей. Терапия направлена на разрыв этого цикла через подавление иммунной активности и удаление комплексов.
Роль циркулирующих иммунных комплексов (ЦИК) в развитии болезни Крона у детей
Роль циркулирующих иммунных комплексов (ЦИК) в развитии болезни Крона у детей можно объяснить следующими ключевыми механизмами и клиническими аспектами:
1. Патогенез воспаления при болезни Крона
- Образование ЦИК: При болезни Крона хроническое воспаление кишечника связано с аномальным иммунным ответом на антигены (например, микробные или собственные). Это приводит к формированию ЦИК, состоящих из антител (IgG, IgM), антигенов и компонентов комплемента .
- Нарушение клиренса: У детей с болезнью Крона часто наблюдается дефект в системе удаления ЦИК. Это связано с недостаточностью фагоцитарной активности или нарушениями в системе комплемента, что способствует накоплению комплексов в тканях кишечника .
- Активация воспаления: Отложение ЦИК в стенке кишечника активирует комплемент, что приводит к выделению провоспалительных медиаторов (C3a, C5a) и привлечению нейтрофилов. Это усиливает повреждение тканей, формирование язв и гранулем — характерных признаков болезни Крона .
2. Диагностическая значимость ЦИК
- Маркер активности заболевания: Повышенный уровень ЦИК в крови коррелирует с активностью воспалительного процесса при болезни Крона. Например, при обострениях у детей отмечается рост концентрации ЦИК, что может использоваться для мониторинга течения болезни .
- Неспецифичность анализа: Хотя ЦИК не являются специфическим маркером болезни Крона, их определение в сочетании с клиническими симптомами (хроническая диарея, боли в животе) и другими исследованиями (колоноскопия, биопсия) помогает подтвердить диагноз .
3. Влияние ЦИК на системные проявления
- Внекишечные осложнения: У детей с болезнью Крона ЦИК могут откладываться в суставах, коже и почках, вызывая артриты, узловатую эритему или гломерулонефрит. Это объясняется их способностью активировать системное воспаление.
- Связь с задержкой роста: Хроническое воспаление, опосредованное ЦИК, нарушает всасывание питательных веществ и выработку гормонов роста, что особенно критично для детей.
4. Терапевтические подходы
- Иммуносупрессия???: Препараты, подавляющие избыточный иммунный ответ (глюкокортикоиды, ингибиторы TNF-α), уменьшают образование ЦИК и воспаление.
- Плазмаферез: В тяжелых случаях применяется для удаления ЦИК из кровотока, что снижает их патогенное воздействие на ткани .
- Контроль инфекций: Поскольку хронические инфекции стимулируют образование ЦИК, антибиотикотерапия может быть частью комплексного лечения.
5. Клинические рекомендации
- Динамическое наблюдение: Регулярное измерение уровня ЦИК помогает оценивать эффективность терапии и прогнозировать рецидивы .
- Интеграция с другими методами: Для диагностики болезни Крона у детей используются также эндоскопия, МРТ и оценка индекса активности (PCDAI), где ЦИК служат дополнительным лабораторным маркером .
Заключение
ЦИК играют важную роль в поддержании хронического воспаления при болезни Крона у детей, участвуя в повреждении тканей и системных осложнениях. Их уровень отражает активность заболевания, но интерпретация требует комплексного подхода. Лечение направлено на подавление избыточного иммунного ответа и устранение последствий накопления ЦИК.
- Возможно ли ожидать развития здоровой иммунной системы ребёнка с болезнью Крона на длительной иммуносупрессивной терапии?
- Развитие здоровой иммунной системы у детей с болезнью Крона (БК) на фоне длительной иммуносупрессивной терапии — сложный вопрос, требующий анализа баланса между контролем заболевания и потенциальными рисками. Вот основные аспекты, основанные на данных из клинических рекомендаций и исследований:
1. Роль иммуносупрессии в лечении БК
Иммуносупрессивная терапия (азатиоприн, метотрексат, биологические препараты) является ключевой для достижения ремиссии и предотвращения осложнений, таких как стриктуры, свищи или абсцессы. У детей БК часто протекает агрессивнее, чем у взрослых, с более высоким риском прогрессирования и хирургических вмешательств .
— Например, стероидорезистентные формы требуют применения ингибиторов фактора некроза опухоли (ФНО-α), которые подавляют избыточный иммунный ответ, но не полностью «отключают» иммунитет .
2. Влияние на иммунную систему
Длительная иммуносупрессия может повышать риски:
- Инфекций (бактериальных, вирусных, грибковых) из-за снижения иммунного надзора .
- Онкологических заболеваний, таких как лимфома или рак кожи, хотя эти риски считаются низкими при монотерапии .
- Нарушений вакцинального ответа, особенно при использовании живых вакцин (например, против кори) .
Однако у детей с активной БК без лечения риски осложнений (например, задержка роста, недоедание, системное воспаление) значительно превышают потенциальные побочные эффекты терапии .
3. Баланс между рисками и пользой
— Контроль воспаления: Адекватная терапия позволяет предотвратить повреждение кишечника, нормализовать всасывание питательных веществ и поддержать физическое развитие, включая рост и половое созревание .
— Индивидуализация лечения: Современные подходы, такие как «стратегия treat-to-target», направлены на минимизацию доз препаратов при сохранении ремиссии. Например, переход с системных кортикостероидов на биопрепараты снижает кумулятивные побочные эффекты .
— Мониторинг: Регулярные анализы крови, оценка уровня антител и инфекционных маркеров (например, вируса Эпштейна-Барр) помогают вовремя корректировать терапию .
4. Поддержка иммунитета
Для снижения негативного влияния терапии рекомендуются:
- Профилактика инфекций: Вакцинация (по индивидуальному графику), избегание контактов с больными .
- Коррекция микробиоты: Пробиотики (например, *Saccharomyces boulardii*) и энтеральное питание улучшают барьерную функцию кишечника .
- Нутритивная поддержка: Диета с высоким содержанием белка и витаминов (особенно D и B12) компенсирует мальабсорбцию .
5. Долгосрочные перспективы
Исследования показывают, что у большинства детей на иммуносупрессивной терапии иммунная система адаптируется, сохраняя базовые защитные функции. Например, после отмены препаратов восстановление иммунного ответа происходит в течение нескольких месяцев .
Важно, что современные биологические препараты (например, ведолизумаб) обладают избирательным действием на кишечник, минимизируя системное подавление иммунитета .
Заключение
Хотя длительная иммуносупрессия сопряжена с рисками, её применение при болезни Крона у детей оправдано, так как предотвращает необратимые повреждения ЖКТ и улучшает качество жизни. Ключевое значение имеет персонализированный подход, регулярный мониторинг и комплексная поддержка иммунитета. Без терапии прогрессирование заболевания наносит больший ущерб, чем потенциальные побочные эффекты препаратов.
- Что означает "поддержка иммунитета" при иммуносупрессивной терапии у больных детей с хроническими заболеваниями?
- "Поддержка иммунитета" у детей на фоне иммуносупрессивной терапии при хронических заболеваниях (например, болезни Крона, ювенильном артрите, аутоиммунных патологиях) — это комплекс мер, направленных на минимизацию рисков инфекций и осложнений, связанных с подавлением иммунной системы, при сохранении контроля над основным заболеванием. Это не стимуляция иммунитета, а защита организма в условиях его ослабления. Вот ключевые аспекты:
1. Профилактика инфекций
- Вакцинация:
- Проводится до начала терапии (по возможности), так как иммуносупрессия снижает эффективность вакцин.
- Используются инактивированные вакцины (например, от гриппа, гепатита В, пневмококка), но живые вакцины (корь, ветрянка, БЦЖ) противопоказаны из-за риска реактивации вирусов.
- У детей на биопрепаратах (например, анти-ФНО) проверяют уровень антител и при необходимости проводят ревакцинацию.
- Гигиена и защита:
- Избегание контактов с больными ОРВИ, COVID-19, кишечными инфекциями - каким образом???.
- Использование масок в общественных местах, тщательное мытьё рук.
2. Нутритивная поддержка
- Коррекция дефицитов:
- Витамин D и цинк — критически важны для работы иммунитета и снижения воспаления.
- Витамины группы В, железо, кальций — восполняют потери из-за мальабсорбции (при болезнях ЖКТ) или приёма препаратов (например, метотрексата).
- Сбалансированная диета:
- Высокобелковая пища (для восстановления тканей), продукты с пробиотиками (йогурты, ферментированные овощи).
- Исключение продуктов, провоцирующих воспаление (при болезни Крона — индивидуальная диета).
3. Коррекция микробиоты кишечника
- Пробиотики (например, *Lactobacillus rhamnosus GG*, *Saccharomyces boulardii*):
- Снижают риск диареи, вызванной антибиотиками или инфекциями.
- Улучшают барьерную функцию кишечника, что особенно важно при болезни Крона.
- Энтеральное питание (при тяжёлых формах БК):
- Восстанавливает слизистую кишечника и баланс микробиоты.
4. Мониторинг и безопасность
- Регулярные анализы:
- Общий анализ крови (контроль лейкоцитов, нейтрофилов), С-реактивный белок (маркёр воспаления).
- Скрининг на латентные инфекции (туберкулёз, гепатиты, вирус Эпштейна-Барр).
- Коррекция доз препаратов:
- При стойкой ремиссии — снижение дозы иммуносупрессантов до минимально эффективной.
5. Индивидуальный подход
- Исключение самолечения:
- Запрет на иммуностимуляторы (например, эхинацею) — они могут спровоцировать обострение аутоиммунного процесса.
- Психологическая поддержка:
- Стресс снижает иммунитет, поэтому важна работа с психологом и адаптация ребёнка к терапии.
6. Долгосрочные стратегии
- После отмены иммуносупрессии (например, при достижении ремиссии) иммунная система постепенно восстанавливается. У большинства детей базовые функции иммунитета сохраняются даже на фоне длительной терапии.
Примеры препаратов и методов:
- При дефиците витамина D — колекальциферол в лечебных дозах.
- Для профилактики пневмоцистной пневмонии — котримоксазол (у пациентов на высоких дозах иммуносупрессантов).
- При герпес-вирусных инфекциях — ацикловир или валацикловир.
Важно!
Все меры поддержки иммунитета согласуются с лечащим врачом. Баланс между контролем основного заболевания и профилактикой осложнений — основа успешной терапии.
- Значит, для защиты иммунитета применяется иммуносупрессивная терапия для детей с нарушениями работы иммунитета?
Нет, это неверное понимание. Иммуносупрессивная терапия не используется для "защиты иммунитета" — она подавляет его активность. Однако её назначают детям с определёнными нарушениями работы иммунной системы, чтобы предотвратить вред, который вызывает избыточная или неправильная активность иммунитета. Разберёмся детально:
Когда применяют иммуносупрессию?
1. Аутоиммунные заболевания (например, ювенильный артрит, системная красная волчанка):
— Иммунная система атакует собственные ткани.
— Иммуносупрессия подавляет аутоагрессию, защищая органы от повреждения.
2. Хронические воспалительные болезни (болезнь Крона, язвенный колит):
— Чрезмерный иммунный ответ разрушает кишечник.
— Терапия снижает воспаление, предотвращая осложнения (свищи, перфорации).
3. Трансплантация органов:
— Чтобы иммунитет не отторг пересаженный орган, его временно подавляют.
Почему это не "защита иммунитета"?
- Иммуносупрессия — это контроль над патологической активностью иммунной системы, а не её укрепление.
- При аутоиммунных и воспалительных заболеваниях иммунитет работает неправильно (как "сломанный механизм"), и его подавление спасает организм от саморазрушения.
Важные нюансы:
1. Иммунодефициты vs. Аутоиммунные болезни
— При иммунодефицитах (например, врождённых нарушениях иммунитета) иммуносупрессия противопоказана — здесь нужна стимуляция иммунитета или заместительная терапия (например, иммуноглобулины).
— При аутоиммунных патологиях иммунитет гиперактивен, и его подавление необходимо.
2. Риски иммуносупрессии
— Повышенная восприимчивость к инфекциям (из-за снижения иммунного ответа).
— Длительное применение требует строгого контроля (анализы крови, вакцинация, профилактика инфекций).
3. Пример из практики
У ребёнка с болезнью Крона иммунные клетки атакуют кишечник, вызывая язвы и кровотечения. Иммуносупрессанты (азатиоприн, анти-ФНО препараты) останавливают это разрушение, но делают организм уязвимее к внешним инфекциям. Поэтому параллельно проводят поддержку иммунитета (вакцины, витамины, гигиена), чтобы снизить риски.
Итог
Иммуносупрессивная терапия не укрепляет иммунитет, а контролирует его патологическую активность при аутоиммунных и воспалительных заболеваниях. Её цель — спасти органы от повреждения, но при этом требуется тщательная защита организма от инфекций. Это баланс между подавлением "вредного" иммунного ответа и сохранением базовой защиты от патогенов.
- Другими словами, при недостаточном количестве T-reg, иммунитет нужно подавлять иммуносупрессивной симптоматической терапией?
Короткий ответ:
- Не совсем так. При дефиците T-reg (регуляторных Т-лимфоцитов) иммуносупрессивная терапия может применяться как временная мера для контроля гиперактивного иммунитета, но она не устраняет саму причину — недостаток T-reg. Это симптоматический подход, а не патогенетический. Разберём детально:
1. Роль T-reg в иммунитете
T-reg — это специализированные клетки, которые подавляют избыточные иммунные реакции и предотвращают аутоагрессию. Их дефицит связан с:
- Аутоиммунными заболеваниями (например, диабет 1 типа, рассеянный склероз).
- Хроническим воспалением (болезнь Крона, псориаз).
- Отторжением трансплантатов.
2. Почему иммуносупрессия при дефиците T-reg?
Если T-reg недостаточно, иммунная система становится гиперактивной (атакует собственные ткани или вызывает неконтролируемое воспаление).
Иммуносупрессивные препараты:
- Временно подавляют патологическую активность (например, глюкокортикоиды, азатиоприн).
- Замедляют разрушение органов, но не восстанавливают баланс T-reg.
Пример:
При аутоиммунном энцефалите (связанном с дефицитом T-reg) иммуносупрессия снижает воспаление в мозге, но не увеличивает количество T-reg.
3. Ограничения иммуносупрессии
- Риски: Инфекции, онкологические заболевания, нарушение работы других органов.
- Не решает проблему: После отмены препаратов аутоиммунный процесс может возобновиться.
4. Альтернативные и перспективные подходы
1. Клеточная терапия:
Экспериментальное введение *аутологичных T-reg* (выращенных из собственных клеток пациента) для восстановления иммунного баланса.
Пример: Клинические испытания при диабете 1 типа.
2. Низкие дозы интерлейкина-2 (IL-2):
Стимулирует рост и функцию T-reg. Используется при системной красной волчанке и васкулитах.
3. Микробиомная коррекция:
Пробиотики и диета, влияющие на дифференцировку T-reg (например, бутират-продуцирующие бактерии).
5. Когда иммуносупрессия оправдана?
- Острые фазы аутоиммунных болезней (угроза жизни или функции органов).
- Отсутствие доступных методов увеличения T-reg (большинство подходов пока на стадии исследований).
Практические рекомендации
- Для пациентов:
Иммуносупрессия — это «скорая помощь», но важно обсудить с врачом долгосрочную стратегию (например, участие в клинических исследованиях T-reg-терапии).
- Мониторинг: Регулярные анализы на уровень T-reg (например, CD4+CD25+FoxP3+ клетки) и маркеры аутоиммунитета (антинуклеарные антитела).
Заключение
Дефицит T-reg требует комплексного подхода:
1. Иммуносупрессия — для экстренного контроля гиперактивности.
2. Поиск методов восстановления T-reg — для долгосрочной ремиссии.
3. Профилактика осложнений (инфекции, дефицит питательных веществ).
Важно! Иммуносупрессия не «лечит иммунитет», а даёт временную передышку, пока наука ищет способы исправить его регуляцию.
- Почему дисбаланс T-reg и противовоспалительных клеток называют гиперактивностью иммунитета?
- Дисбаланс регуляторных Т-клеток (T-reg) и других противовоспалительных клеток называют гиперактивностью иммунитета, потому что это состояние приводит к неконтролируемому или чрезмерному иммунному ответу. Вот ключевые причины такой терминологии:
1. Роль T-reg и противовоспалительных клеток
- T-reg (регуляторные Т-лимфоциты) — это «тормоза» иммунной системы. Они:
- Подавляют активность провоспалительных клеток (Th1, Th17, цитотоксических Т-лимфоцитов).
- Предотвращают аутоиммунные реакции, останавливая атаку на собственные ткани.
- Поддерживают иммунную толерантность (например, к безвредным антигенам пищи или комменсальным бактериям).
- Противовоспалительные клетки (например, Th2, M2-макрофаги, Treg-ассоциированные дендритные клетки) выделяют цитокины (IL-10, TGF-β), которые гасят воспаление.
2. Что происходит при дисбалансе?
Если T-reg и противовоспалительные клетки недостаточно активны или их количество снижено:
- Провоспалительные клетки (Th1, Th17) выходят из-под контроля.
- Иммунная система начинает атаковать собственные ткани (аутоиммунитет) или реагирует слишком сильно на безвредные стимулы (аллергии, хроническое воспаление).
- Примеры:
- При дефиците T-reg у мышей развивается смертельный аутоиммунный лимфопролиферативный синдром.
- У людей с низким уровнем T-reg чаще возникают рецидивы рассеянного склероза или болезни Крона.
3. Почему термин «гиперактивность»?
Гиперактивность иммунитета — это отсутствие «тормозов», а не просто «ускорение». Даже если провоспалительные клетки работают в нормальном режиме, без контроля T-reg их активность становится разрушительной.
Аналогия: Представьте автомобиль без тормозов — он будет нестись uncontrollably, даже если двигатель работает на стандартной скорости.
4. Как это проявляется в болезнях?
- Аутоиммунные заболевания (диабет 1 типа, ревматоидный артрит):
T-reg не могут сдержать атаку Т-клеток на β-клетки поджелудочной железы или суставы.
- Хронические воспалительные болезни (болезнь Крона, псориаз):
Преобладание провоспалительных цитокинов (TNF-α, IL-17) над противовоспалительными (IL-10).
- Аллергии и астма:
Дисбаланс между Th2 (провоспалительными) и T-reg приводит к гиперреакции на аллергены.
5. Молекулярные механизмы
- Сигнальные пути: При дефиците T-reg нарушается работа путей, зависимых от FoxP3 (главного регулятора T-reg) и CTLA-4 (молекулы, подавляющей активацию Т-клеток).
- Цитокиновый дисбаланс: Снижение уровня IL-10 и TGF-β (подавляющих воспаление) при избытке IFN-γ, IL-6, IL-17.
6. Как гиперактивность подтверждается на практике?
- У пациентов с аутоиммунными заболеваниями в крови часто обнаруживают:
- ↓ Количество T-reg (CD4+CD25+FoxP3+).
- ↑ Уровень провоспалительных цитокинов (IL-6, TNF-α).
- Эксперименты: Введение T-reg мышам с колитом уменьшает воспаление.
Итог
Термин «гиперактивность иммунитета» отражает утрату баланса между активацией и подавлением иммунного ответа. Даже если провоспалительные клетки функционируют нормально, без достаточного количества T-reg и противовоспалительных агентов их действие становится чрезмерным и патологическим. Это ключевой механизм многих хронических и аутоиммунных заболеваний.
- ...Да, но это дисбаланс и иммунная недостаточность в T-reg. Так ли это?
- Вы абсолютно правы, что дисбаланс T-reg связан с нарушением регуляции иммунитета, но называть это состояние «иммунной недостаточностью» не совсем корректно. Давайте разберёмся в терминах и механизмах:
Почему это не «иммунная недостаточность» в классическом понимании?
1. Иммунная недостаточность (иммунодефицит) — это состояние, при котором иммунная система не может адекватно защищать организм от инфекций (например, врождённые дефекты лимфоцитов, ВИЧ).
2. Дисбаланс T-reg — это дисрегуляция иммунитета, когда система сохраняет силу, но теряет способность отличать «своё» от «чужого» и контролировать воспаление.
Пример:
- При дефиците T-reg иммунитет может быть даже гиперактивным (аутоиммунные атаки, аллергии), но при этом сохранять защиту от бактерий и вирусов (если нет параллельной иммуносупрессивной терапии).
Ключевые отличия
| Параметр | Иммунная недостаточность | Дисбаланс T-reg |
|-----------------------------|-------------------------------------------------------|-----------------------------------------------------------------------|
| Основная проблема | Слабость иммунного ответа | Неправильная регуляция иммунитета |
| Типичные проявления | Частые инфекции, сепсис | Аутоиммунные болезни, хроническое воспаление |
| Примеры заболеваний | ВИЧ, агаммаглобулинемия | Рассеянный склероз, диабет 1 типа, болезнь Крона |
| Риск инфекций | Высокий (из-за слабого иммунитета) | Обычно нормальный, но повышается при иммуносупрессивной терапии |
Почему путают термины?
Дисбаланс T-reg иногда называют «функциональной иммунной недостаточностью», но это метафора. Речь идёт не о недостатке иммунных клеток, а о потере их регуляторной функции.
Аналогия: Представьте полицейских (T-reg), которые перестали контролировать толпу (провоспалительные клетки). Толпа бунтует, но это не значит, что полиции вообще нет — она просто не выполняет свою роль.
Как правильно охарактеризовать дисбаланс T-reg?
1. Иммунная дисрегуляция — точный термин, отражающий нарушение баланса между активацией и подавлением иммунного ответа.
2. Дефицит иммунной толерантности — неспособность иммунитета «игнорировать» собственные ткани или безвредные антигены.
Перспективы коррекции
Современные методы направлены не на «усиление иммунитета», а на восстановление регуляции:
- Клеточная терапия: Трансплантация T-reg или их стимуляция через IL-2.
- Микробиомные: Кишечные бактерии (например, *Clostridia*) могут индуцировать дифференцировку T-reg.
- Генная инженерия: Редактирование генов (например, усиление экспрессии FoxP3 — главного регулятора T-reg).
Итог
Да, дисбаланс T-reg — это серьёзное нарушение иммунной регуляции, но называть его «иммунной недостаточностью» некорректно. Это отдельная категория патологий, где иммунитет не слаб, а потерял способность к самоконтролю. Именно поэтому терапия таких заболеваний требует не стимуляции, а тонкой перенастройки иммунной системы.
Дисбаланс в популяции и/или функции регуляторных Т-клеток (T-reg) является одной из ключевых причин развития аутоиммунных заболеваний. Вот почему:
* Функция T-reg: T-reg клетки являются важнейшей частью иммунной системы, ответственной за поддержание иммунной толерантности. Они подавляют активность других иммунных клеток, предотвращая их атаку на собственные ткани организма. Это необходимо для предотвращения аутоиммунных реакций.
* Дисбаланс при аутоиммунных заболеваниях: При аутоиммунных заболеваниях наблюдается снижение количества и/или нарушение функции T-reg клеток. Это приводит к тому, что иммунная система теряет контроль и начинает агрессивно атаковать собственные клетки и ткани, вызывая воспаление и повреждение органов.
* Различные механизмы дисбаланса:
Дисбаланс T-reg может возникать по нескольким причинам:
* Сниженное количество T-reg: Может быть нарушена продукция T-reg в тимусе или их выживаемость в периферических тканях.
* Нарушение супрессивной функции T-reg: T-reg клетки могут быть неспособны эффективно подавлять другие иммунные клетки.
* Резистентность эффекторных Т-клеток к супрессии: Другие иммунные клетки (эффекторные Т-клетки) могут становиться менее чувствительными к супрессивному действию T-reg.
* Дисбаланс между различными субпопуляциями Т-хелперов: Например, нарушение баланса между провоспалительными Th17 клетками и противовоспалительными T-reg клетками часто наблюдается при аутоиммунных заболеваниях.
* Связь с различными аутоиммунными заболеваниями: Нарушения в популяции и функции T-reg были обнаружены при многих аутоиммунных заболеваниях, включая:
* Ревматоидный артрит
* Системная красная волчанка
* Рассеянный склероз
* Сахарный диабет 1 типа
* Воспалительные заболевания кишечника
* Аутоиммунные заболевания щитовидной железы и многие другие.
Таким образом, хотя аутоиммунные заболевания являются многофакторными и вызываются сочетанием генетических и средовых факторов, дисбаланс T-reg играет центральную роль в патогенезе многих из этих состояний. Исследования, направленные на восстановление баланса и функции T-reg, являются перспективным направлением в разработке новых методов лечения аутоиммунных заболеваний.
Кишечные комменсальные микробы как иммунные модуляторы
Комменсальные бактерии необходимы для развития и поддержания здоровой иммунной системы. Использование способности микробиоты влиять на иммунитет хозяина считается важной терапевтической стратегией для многих слизистых и немукозальных иммунных состояний, таких как воспалительные заболевания кишечника (ВЗК), целиакия, метаболический синдром, диабет и микробные инфекции.
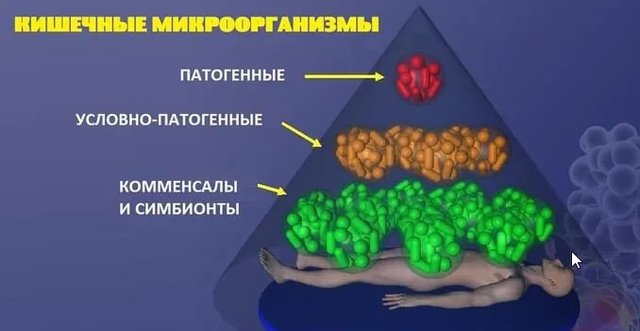
В дополнение к хорошо установленным иммуностимулирующим эффектам микробиоты, было описано присутствие отдельных мутуальных комменсальных бактерий с иммуномодулирующим эффектом. Эти организмы являются постоянными членами комменсальной микробиоты и специфическим образом влияют на иммунный гомеостаз хозяина.
Выявление отдельных примеров таких иммуномодулирующих комменсалов и понимание механизмов их взаимодействия с хозяином будет иметь неоценимое значение при разработке терапевтических стратегий для устранения дисбактериоза кишечника и восстановления иммунологического гомеостаза.
Взаимодействия «микроб-хозяин» в кишечнике
Десятилетия исследований на животных без микробов (GF) установили важность микробиоты для правильной иммунной функции хозяина (Macpherson and Harris, 2004). Животные GF были впервые созданы более века назад (Nuttal and Thierfeledr, 1895-1896), а долгосрочное разведение крыс GF стало возможным с 1940-х годов (Reyniers et al., 1946). Однако до недавнего времени состав микробных сообществ кишечника оставался в значительной степени неизвестным. Достижения в области высокопроизводительного секвенирования в последние несколько лет привели к обширной каталогизации микробиоты человека (Human Microbiome Project Consortium, 2012). В дополнение к корреляции изменений в составе микробиоты с заболеванием, это позволило идентифицировать комменсальные виды со специфическими иммунными эффектами. Подавляющее большинство этих исследований было сосредоточено на бактериальном компоненте микробиоты, однако в настоящее время проводится характеристика грибкового и вирусного компонентов и их функции (Iliev et al., 2012; Reyes et al., 2012).
Состав микробиоты человека является динамичным. Он меняется с возрастом и колеблется в зависимости от изменений окружающей среды, таких как географическое положение, диета, использование антибиотиков или приток и отток внешних микробов (Clemente et al., 2012). Кроме того, в разных частях тела проживают совершенно разные микробные сообщества (Costello et al., 2009). На основании их способности к колонизации бактерии в кишечнике могут быть временными (транзиторными) или постоянными. Транзиторные бактерии представляют собой микробы, которые вводятся в течение взрослой жизни из внешней среды и не подвергаются постоянной колонизации кишечного тракта по различным причинам, таким как отсутствие соответствующих приспособлений для колонизации или неспособность конкурировать с резидентной микробиотой. Многие связанные с пищевыми продуктами микробы, включая патогены и обычные коммерческие пробиотики, являются частью этой категории. Переходные организмы могут влиять на иммунную систему по-разному и быть безвредными, патогенными или даже полезными, например, при приеме пищи, содержащей пробиотики. Эти организмы не эволюционировали совместно и поэтому не устанавливают взаимных отношений с хозяином, а скорее пытаются выжить в кишечной среде, несмотря на установленную защиту хозяина. Действительно, многие острые кишечные патогены разработали стратегии насильственной колонизации кишечника, которая в большинстве случаев вызывает сильный иммунный ответ, направленный на очистку патогена. Патологические иммунологические последствия этого воспалительного ответа могут сохраняться в течение многих лет после очистки от переходных организмов, как при постинфекционном синдроме раздраженного кишечника (Spiller and Garsed, 2009).
В отличие от переходных бактерий, постоянные бактерии являются долгосрочными членами микробного сообщества. Их колонизация происходит последовательными волнами в течение онтогенеза, и они развили эволюционную адаптацию, чтобы установить постоянные отношения с хозяином. В большинстве случаев они эволюционировали совместно с хозяином и обычно не встречаются в качестве свободноживущих организмов. Это истинные комменсальные бактерии. Комменсалы оказывают многократное воздействие на иммунную систему хозяина. С одной стороны, наличие большого количества ‘безобидных’ бактерий оказывает иммуностимулирующее действие. Комменсалы стимулируют общий набор иммунных клеток в слизистую оболочку, а также генерацию и созревание организованных кишечно-ассоциированных лимфоидных тканей (Macpherson and Harris, 2004). Они также стимулируют защитные функции эпителиальных клеток, такие как секреция слизи и антимикробных пептидов (Hooper and Macpherson, 2010). С другой стороны, недавние исследования выявили наличие комменсальных видов с иммуномодулирующими эффектами. Эти эффекты специфичны для отдельных бактерий или групп бактерий, т. е. для конкретных компонентов микробиоты. Они включают обратимые изменения в дифференцировке или эффекторной функции подмножеств иммунных клеток хозяина. Таким образом, состав микробиоты может влиять на тип и устойчивость иммунных реакций хозяина. Здесь мы имеем в виду таких постоянных членов микробиоты с иммуномодулирующим эффектом, как аутобионты (автобионты).
В отличие от преходящих патогенных микроорганизмов или патобионтов, иммунные эффекты аутобионтов являются более тонкими, поскольку они не вызывают каких-либо явных изменений в состоянии здоровья хозяина. Скорее, они помогают поддерживать и регулировать здоровое устойчивое состояние организма хозяина. Постоянные члены микробиоты, которые могут демонстрировать вредные эффекты в особых условиях, называются патобионтами. Патобионты колонизируют хозяина, но не вызывают заболевания с полным дополнением нормальной микробиоты. Однако они могут расширяться и вызывать заболевание, если нарушается микробиота или иммунный гомеостаз хозяина (например, после лечения антибиотиками или в условиях воспаления кишечника).
В отличие от патогенов, патобионтов и даже пробиотиков, очень мало известно о механизмах, с помощью которых автобионты оказывают свое иммуномодулирующее действие. До недавнего времени одной из причин этого было отсутствие конкретных примеров иммуномодулирующих комменсалов. Другой причиной является сложность культивирования этих организмов ex vivo и относительное отсутствие генетических инструментов для изучения их геномной функции. В этом обзоре мы сосредоточимся на недавно описанных примерах иммуномодулирующих комменсалов и предположим о потенциальных клеточных и молекулярных механизмах, участвующих в их взаимодействии с хозяином и установлении здорового устойчивого иммунного состояния. Знание этих механизмов может помочь в разработке будущих методов лечения кишечных заболеваний (Clemente et al., 2012).
Кишечное микробное сообщество влияет на иммунитет
В установившихся условиях микробиота влияет на развитие и функционирование различных популяций иммунных клеток, включая IgA-секретирующие плазматические клетки, клетки Th17, регуляторные клетки T (Treg), инвариантные клетки T (iNKT) естественных киллеров, γδ-Т клетки, NK клетки, макрофаги, дендритные клетки (DC) и врожденные лимфоидные клетки (ILC) (Honda and Littman, 2012). Например, плазматические клетки IgA+ в лимфоидных тканях кишечника и собственной пластинчатой оболочке (LP) значительно снижены у GF или у обычных животных, получавших антибиотики (Macpherson and Harris, 2004). В другом примере обилие и функции CD4+ T-клеток, экспрессирующих фактор транскрипции FoxP3 (Tregs) или интерлейкина IL-17 (клетки Th17) в слизистой оболочке кишечника в устойчивом состоянии, подвержены влиянию микробиоты. У GF или мышей, получавших антибиотик, процентное содержание клеток Tregs и Th17 заметно снижается, а экспрессия иммуносупрессивного цитокина IL-10 в клетках Treg значительно снижается (Atarashi et al., 2008, 2011; Ivanov et al., 2008). Эти сокращения быстро восстанавливаются путем трансплантации кишечной или фекальной микробиоты от мышей с обычным выращиванием / без специфических патогенов (SPF - Specific-pathogen-free). Как описано ниже, развитие этих подмножеств CD4+ Т-клеток по-разному регулируется некоторыми компонентами микробиоты кишечника, включая Bacteroides fragilis, виды Clostridia и сегментированные нитевидные бактерии (SFB) (Atarashi et al., 2011; Ivanov et al., 2009; Round and Mazmanian, 2010) (Таблица 1). Клетки Th17 способствуют защите хозяина от инфекции патогенными микробами, но также могут усиливать вредные аутовоспалительные функции, тогда как Tregs играют критическую роль в подавлении иммунитета. Следовательно, при здоровых условиях клетки Th17 и Tregs должны сосуществовать в хорошо регулируемом балансе. Конкретные комбинации и относительное содержание соответствующих видов комменсалов будут генерировать различные иммунные среды и иммунные ответы у хозяина.
Помимо стимулирования развития или рекрутирования подмножеств иммунных клеток-хозяев, микробиота также может влиять на функцию этих подмножеств. Например, кишечная микробиота обеспечивает среду не только для накопления клеток IgA+, но и для функционального созревания плазматических клеток IgA+ путем индукции генерации плазменных клеток iNOS+ IgA+ (Fritz et al., 2012). Плазматические клетки iNOS+ IgA+ (т.е. индуцибельные NO-синтазы-продуцирующие IgA+ плазматические клетки) отсутствуют у мышей GF, но присутствуют у мышей с обычным выращиванием. Это подмножество играет критическую роль в усилении развития плазматических клеток IgA+ и защите хозяина от кишечных патогенов, таких как Citrobacter rodentium (Fritz et al., 2012). Комменсальные бактерии также влияют на функцию NK-клеток. Несмотря на то, что количество NK-клеток в норме у мышей GF, NK-клеточное праймирование и противовирусная активность недостаточны в отсутствие микробиоты (Ganal et al., 2012). Этот эффект обусловлен направленным на микробиоту внесением эпигенетических изменений и индукцией интерферонов типа I из моноцитарных макрофагов, которые необходимы для правильного праймирования NK-клеток (Ganal et al., 2012).
Контролируемые микробиотой иммунные эффекты также могут играть роль в регуляции самой микробиоты. Индуцированные комменсалом плазматические клетки IgA+ способствуют контролю численности и состава микробиоты. Например, мыши, несущие мутацию knockin активационно-индуцированной цитидин-дезаминазы (AID) (AIDG23S), которая может опосредовать нормальное переключение классов IgA, но не может индуцировать соматическую гипермутацию и высокоаффинные реакции IgA, демонстрируют чрезмерную пролиферацию анаэробных бактерий в тонком кишечнике (Wei et al., 2011). О подобном разрастании микробиоты также сообщалось у PD-1 дефицитных мышей (с дефицитом белка 1 запрограммированной клеточной гибели), у которых было усилено развитие фолликулярных хелперных T (TFH) клеток, и, следовательно, низкоаффинные IgA-продуцирующие плазматические клетки аберрантно отбирались в зародышевых центрах (Kawamoto et al., 2012). Таким образом, микробиота необходима для развития полностью функциональных клеток IgA+, которые в свою очередь функционируют для поддержания микробного гомеостаза в кишечнике.
Микробиота также играет подавляющую роль в функции и накоплении иммунных клеток в кишечнике. Например, она подавляет конститутивную продукцию IL-22 в клетках индуктора лимфоидной ткани (LTi) и клетках NKp46+ (обе из которых являются RORγt+ ILC) через эпителиальную экспрессию IL-25 (Sawa et al., 2011). Другим примером является то, что раннее воздействие на микробиоту кишечника обеспечивает эпигенетическую супрессивную маркировку в регуляторном элементе гена CXCL16 у хозяина, что приводит к пожизненному подавлению экспрессии CXCL16 в кишечнике и легких (Olszak et al., 2012). Это подавление сопровождается уменьшением количества клеток iNKT в толстой кишке и легких в устойчивом состоянии и влияет на устойчивость хозяина к колиту и астме (Olszak et al., 2012). Взятые вместе, кишечная микробиота обеспечивает разнообразные сигналы для активации и подавления иммунной системы, тем самым обладая способностью смещать иммунный статус хозяина в сторону либо эффекторного, либо регуляторного доминирования.
Комменсалы имеют иммуномодулирующие функции не только в кишечнике. Например, резидентные комменсалы в коже вызывают местные реакции Th17 и Th1, которые имеют решающее значение для защиты от бактериальных инфекций (Naik et al., 2012). Что еще более важно, эти ответы были разделены на кожу и не зависели от кишечных комменсалов (Naik et al., 2012).
Комменсалы влияют на патогенез многих заболеваний. Поскольку это сообщество эволюционно установлено для поддержания здорового иммунного устойчивого состояния, любые серьезные нарушения в его составе могут иметь негативные последствия и закрепить цикл хронического воспаления, аллергии или метаболического синдрома. Такой «дисбактериоз» может быть вызван диетой, фармакологическими агентами, инфекцией, воспалением и генетикой хозяина (Honda and Littman, 2012). После установления дисбиотической микробиоты она может стать стабильной и пригодной для трансплантации животным или даже условно выращенным животным. Действительно, совместное проживание мышей дикого типа с мышами-мутантами, страдающими болезнями, такими как мыши Tbet-/- Rag-/-, Nrlp6-/- или Asc-/- (-/-дефицитные – ред.), приводит к переносу дисбиотической микробиоты и предрасположенности мышей дикого типа к заболеванию, включая колит и метаболический синдром (Elinav et al., 2011; Garrett et al., 2007; Henao-Mejia et al., 2012).
Дисбактериоз может привести к элиминации полезных бактерий или росту патобионтов. Патобионты являются постоянными членами микробиоты, присутствующими в низких концентрациях и безвредными в нормальных условиях (табл.1). Они могут стать патогенными, если им позволить достаточное расширение из-за потери микробиоты или иммунного гомеостаза. Например, чрезмерный рост членов Prevotellaceae и TM7 связан с чувствительностью хозяина к колиту DSS у Nrlp6-/- мышей (Elinav et al., 2011). У мышей Tbet-/- Rag-/- было выявлено, что Proteus mirabilis и Klebsiella pneumoniae, по крайней мере частично, ответственны за фенотип спонтанного колита (Garrett et al., 2010). Наиболее важно то, что восприимчивость к болезням передавалась мышам дикого типа.
Состав кишечной микробиоты также изменяется в зависимости от диеты. Рационы, богатые молочным жиром и таурохолевой кислотой, вызывали заметное увеличение колонизации Bilophila wadsworthia, что связано с усилением ответов Th1 и ускорением развития колита у мышей IL-10-/- (Devkota et al., 2012). Следует отметить, что в зависимости от генотипа хозяина безвредные симбионты могут стать патогенными. Действительно, на мышиной модели воспалительного заболевания кишечника (IBD) с дефицитом передачи сигналов IL-10 и TGF-β, Bacteroides thetaiotaomicron, хорошо охарактеризованный симбиотический вид, мощно индуцирует колит (Bloom et al., 2011).
Аутобионты - мутуалистические иммуномодулирующие микробы
Как обсуждалось выше, имеется множество доказательств того, что микробиота направляет иммунитет хозяина. Регуляция иммунных реакций путем влияния на развитие, дифференцировку или эффекторную функцию различных клеток иммунной системы особенно интересна, поскольку она обусловлена не просто присутствием безобидных бактерий, но и биологической активностью комменсалов. Во многих случаях эти эффекты функционально различны, например, индукция Th17 клеток против Tregs, и зависят от активности различных членов комменсального сообщества. Относительное обилие этих «автобионтов» может направлять общий тип иммунитета в слизистой оболочке хозяина индивидуума в данный момент времени. В настоящее время существует относительно мало конкретных примеров комменсалов с иммуномодулирующими эффектами, как описано ниже. В будущем, несомненно, будут выявлены и другие.
Несмотря на значительное видовое разнообразие, кишечная микробиота большинства млекопитающих состоит из бактерий, принадлежащих к двум основным типам - грамотрицательным Бактериоидам и грамположительным Фирмикутам. Это, вероятно, отражает эволюционную адаптацию этих типов к выживанию в кишечной среде, и оба они содержат важные иммуномодулирующие комменсалы.
Автобионты являются постоянными членами нормальной комменсальной микробиоты. Они контролируют иммунный гомеостаз в собственной пластинке слизистой оболочки, например, индуцируя различные подгруппы эффекторных Т-клеток (контроль Т-клеточного гомеостаза). Относительные пропорции клеток Th17 и Treg зависят от относительного присутствия разных аутобионтов, например, у разных индивидуумов, в разных местах кишечника или на разных стадиях онтогенеза. Эти взаимные взаимодействия поддерживают здоровое устойчивое состояние. Потеря аутобионтов и общий дисбактериоз нарушает также иммунный баланс хозяина.
Дисбактериоз может возникнуть несколькими способами. Инвазивные кишечные патогены вызывают временные инфекции, но могут привести к длительным нарушениям микробиоты из-за сильных воспалительных реакций против патогена. Лечение антибиотиками (Abx) или воспаление, вызванное физическим повреждением слизистой оболочки, может также привести к дисбиозу и росту патобионтов, которые являются постоянными членами микробиоты, но не вызывают заболевания в присутствии аутобионтов. Генетические факторы хозяина могут также инициировать или закреплять дисбиоз. Дисбактериоз приводит к потере иммуномодулирующих эффектов аутобионтов и приводит к нарушению иммунного баланса, который при соответствующих условиях может проявиться в болезни. Болезненное состояние усиливает дисбактериоз в порочном круге. Автобионты и обычные пробиотики - это микоорганизмы с благотворным действием. Пробиотики обладают временными эффектами и могут повысить иммунитет хозяина. Аутобионты являются частью нормальной микробиоты и разработали эволюционные приспособления для колонизации хозяина, регулирования иммунитета хозяина и установления здорового иммунного состояния. Таким образом, аутобионты могут обратить как дисбактериоз, так и иммунный гомеостаз.
Bacteroidetes и Clostridia используют широкий спектр ферментов, способных расщеплять полисахариды и олигосахариды до короткоцепочечных жирных кислот (SCFAs), таких как уксусная кислота, пропионовая кислота и масляная кислота (Flint et al., 2008). SCFAs влияют на физиологию хозяина, включая моторику кишечника и развитие колоноцитов. Кроме того, SCFAs способствуют поддержанию кишечного иммунного гомеостаза. Действительно, метаболизм бутирата нарушается у пациентов с язвенным колитом, и местное лечение бутиратом натрия или клизмами бутирата являются эффективными методами лечения (Scheppach et al., 1992; Vernia et al., 2003). Мыши GF очень чувствительны к колиту, опосредованному декстрансульфатом натрия (DSS), но обработка мышей GF ацетатом в питьевой воде заметно улучшает показатели заболевания колитом (Maslowski et al., 2009). Известно, что SCFAs действуют как внеклеточные сигнальные молекулы, которые активируют рецепторы, связанные с G-белком, такие как GPR41 и GPR43. Рецептор GPR41 экспрессируется подмножеством IECs и контролирует влияние микробиоты на сбор энергии и ожирение (Samuel et al., 2008). GPR43 экспрессируется нейтрофилами и эозинофилами и передает иммуномодулирующие сигналы, полученные из микробов. Gpr43-/- нейтрофилы обладают внутренним гиперреактивным фенотипом, в том числе гиперпродукцией активных форм кислорода (АФК) и высокой хемотаксической активностью (Maslowski et al., 2009). Не известно, участвует ли передача сигналов SCFAs в индукции Th17-клеток и Tregs автобионтами. Однако, учитывая, что Bacteroidetes и Firmicutes являются высокими продуцентами SCFAs (Flint et al., 2008), передача сигналов SCFA-GPR может представлять собой важный молекулярный путь, активируемый комменсалами для регуляции иммунных и воспалительных реакций и поддержания барьера слизистой оболочки.
Терапевтическое использование кишечных микробов или их продуктов
Хотя трансплантация кала установила доказательство принципа осуществимости манипулирования микробиотой человека в качестве терапевтической стратегии (Khoruts and Sadowsky, 2011), лечение специфическими микроорганизмами является более желательным для медицинских целей. Многие из обычных пробиотических микроорганизмов традиционно использовались для сохранения пищевых продуктов путем ферментации и не обязательно являются частью нормальной микробиоты (O’Toole and Cooney, 2008). Другими словами, традиционные пробиотики не были рационально выделены из микробиоты с целью усиления специфических функций иммунной системы хозяина или для устранения конкретного комменсального дисбиоза. Как описано ранее, несколько линий доказательств предполагают, что дисбиотическая микробиота может быть высокостабильным комплексом и поэтому не поддается лечению отдельными временными пробиотическими штаммами.
Действительно, несмотря на многообещающие данные, полученные на животных моделях, большинство пробиотиков, протестированных на сегодняшний день, продемонстрировали посредственные эффекты в клинике, особенно для лечения ВЗК. Таким образом, существует настоятельная необходимость в идентификации более устойчивых терапевтических организмов, которые совместимы с хозяином и могут влиять на иммунную систему хозяина хорошо контролируемым, физиологическим образом. В идеале эти организмы будут способны вызывать более широкие изменения в микробной экосистеме и способны уменьшать дисбактериоз. Такие терапевтические организмы могут включать некоторые традиционные пробиотики, но наиболее перспективными кандидатами являются иммуномодулирующие аутобионты. Аутобионты способны стать постоянными членами микробиоты и, следовательно, могут восстанавливать дисбиоз и ингибировать рост патогенных микроорганизмов или патобионтов. Действительно, колонизация SFB может снижать репликацию энтеропатогенной кишечной палочки у кроликов (Heczko et al., 2000), Salmonella enteritidis у крыс (Garland et al., 1982) и Citrobacter rodentium у мышей (Ivanov et al., 2009). Было показано, что колонизация с местными Clostridia и Lactobacilli, выделенными от обычных мышей, эффективно контролирует экспансию E. coli в толстой кишке мышей (Itoh and Freter, 1989). В то же время аутобионты сосредоточены на независимых воздействиях на иммунную систему, которые являются относительно более тонкими и направлены на поддержание кишечного иммунного гомеостаза. SFB и Clostridia индуцируют контролируемое размножение клеток Th17 или Tregs независимо друг от друга, и индуцированные клетки Th17 или Treg не превышают уровни у SPF-мышей и не вызывают явного воспалительного заболевания или иммунодефицита.
Следовательно, механизмы, контролирующие иммунные эффекты, вызванные аутобионтом, являются более «физиологичными».
Характеристика клеточных и молекулярных механизмов, ответственных за эффекты в каждом примере взаимодействия автобионт-хозяин, имеет решающее значение при разработке методов лечения, которые не будут основываться на колонизации живыми бактериями, а вместо этого будут использовать специфические малые молекулы, имитирующие их благотворное воздействие. Например, несмотря на то, что SFB еще не были найдены в человеческих метагеномных базах данных (Sczesnak et al., 2011), молекулярные и клеточные механизмы иммунной модуляции SFB все еще могут сохраняться и приниматься другими комменсалами у людей. Характеристика таких молекулярных механизмов позволит разработать рационально разработанные комбинации таргетных агентов для усиления иммунной системы желательным образом или корректировать последствия дисбактериоза кишечника для лечения различных иммунных заболеваний.
Источник: Ivaylo I. Ivanov & Kenya Honda. Intestinal. Commensal Microbes as Immune Modulators. Cell Host & Microbe 12, October 18, 2012 pp. 496-508
- « первая
- ‹ предыдущая
- …
- 67
- 68
- 69
- 70
- 71
- 72
- 73
- 74
- 75
- …
- следующая ›
- последняя »
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии






